腾盛博药-B 递表港交所,临床Ⅲ期将是公司的关键考核
若能成功证明公司在 siRNA 药物上的研发能力,公司的未来才会是真正的星辰大海
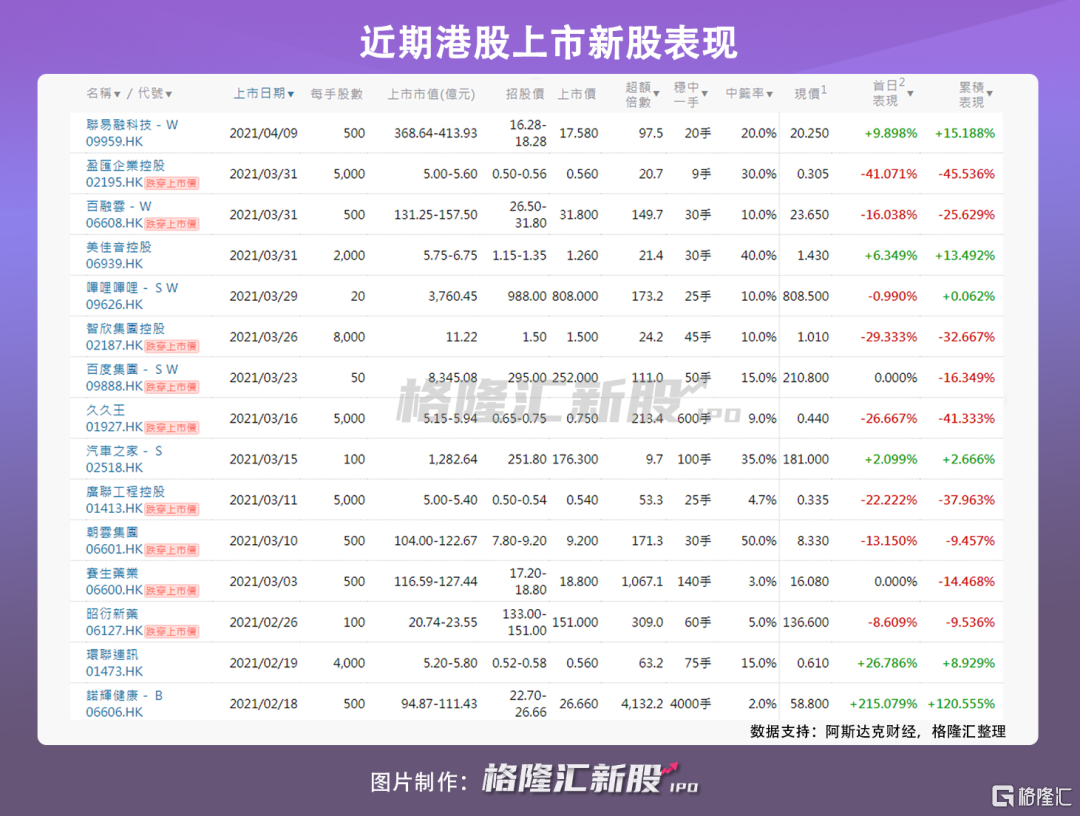
自诺辉健康-B 创造出超购 4000 多倍,中签一手获利约 2.5 万的神话之后,港股打新市场进入了相对长期的低迷。一方面,由于全球市场的整体走弱,投资者进入了冷静期,参与者每次打新之前都更加审慎。
另一方面,市场急跌也使得大家不再过分聚焦收益率,转而更关注公司基本面和安全边际,港股打新市场进入了更理性的状态。
在近期递表港交所的诸多公司中,一家未盈利生物科技公司腾盛博药-B 有些特别,和过往登录港交所的生物科技公司明显不同。
以往上市的为盈利生物科技公司大多数专注肿瘤靶向治疗领域,而这家特别的公司则主要针对以传染性疾病为代表的公共卫生疾病,其技术路径也使用了更前沿的 siRNA 技术。那么,这只特别的新股腾盛博药-B 到底质地如何呢?所处赛道是否值得关注呢?
1
全球领先 siRNA 技术平台,专注攻克公共卫生疾病
腾盛博药成立于 2017 年,其药物开发方向主要是中国及全球的各种重大传染病(如乙型肝炎病毒 (HBV)、人类免疫缺陷病毒 (HIV)、多重耐药 (MDR) 或广泛耐药性 (XDR) 革兰氏阴性菌感染)及其他具有重大公共卫生负担的疾病(如中枢神经系统 (CNS) 疾病)。
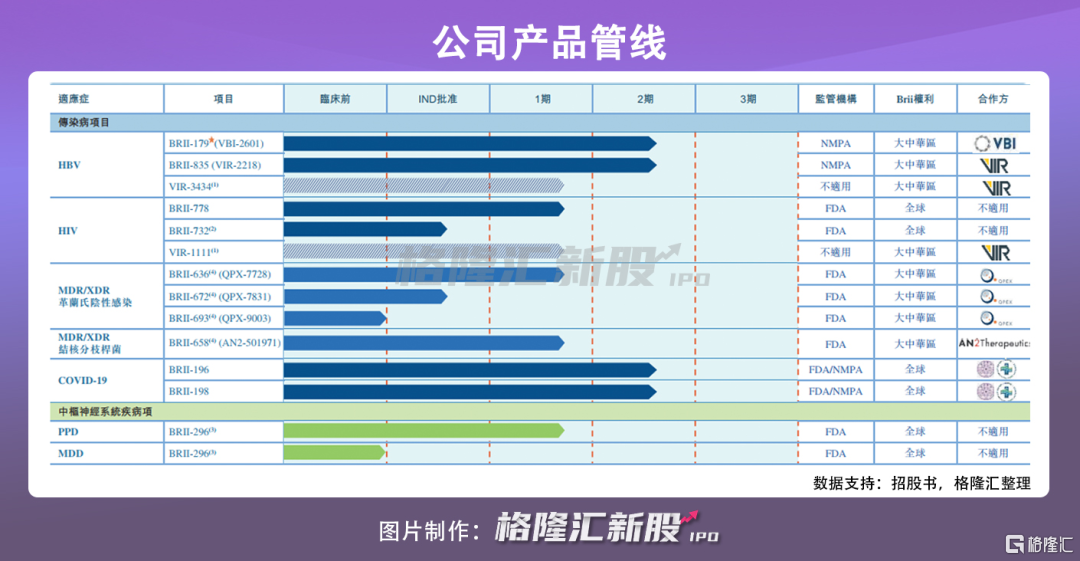
目前公司已建立一条针对传染病及 CNS 疾病的管线,包含由 10 多个涵盖临床前到临床阶段项目的创新候选产品,以及授权合作伙伴的最多五个额外创新项目进行授权新药。其中,传染病项目包括:
(1)联合使用 HBV 特异性 B 细胞及 T 细胞治疗性免疫蛋白 (BRII-179) 以及靶向 HBVsiRNA(BRII-835) 的 HBV 功能性治愈。
(2)可提升 HIV 患者生命质量的每星期一次的单片治疗(QWSTR)(BRII-778 及 BRII-732)。
(3)OMNIvance®(与 IVβ-内酰胺抗生素联合使用的广谱β-内酰胺酶抑制剂(BLI)BRII-636)、ORAvance®(与 IVβ-内酰胺抗生素联合使用的广谱 BLIBRII-672)以及用于治疗 MDR/XDR 革兰氏阴性细菌感染的新一代多黏菌素 (BRII-693)。
(4)用于治疗 MDR/XDR 结核病(TB)和分枝杆菌感染的 BRII-658。
(5)用于治疗 COVID-19 的两种全人源非竞争性中和抗体(BRII-196 及 BRII-198)联合鸡尾酒疗法。
CNS 疾病项目则为治疗 PPD 及 MDD 的 BRII-296。
公司的核心产品为 BRII-179 和 BRII-835,该项目自 VBI 和 Vir 处获得许可,正在开发 HBV 功能性治愈疗法联合使用 HBV 特异性 B 细胞及 T 细胞治疗性免疫蛋 (BRII-179) 以及靶向 HBV 的 siRNA(BRII-835)。公司已在中国、香港、新西兰、澳大利亚、泰国和韩国进行 BRII-179 的 1b/2a 期临床研究,并在中国进行 BRII-835 的 2 期临床研究。
并且,公司计划于 2021 年 3 月在新西兰就 BRII-179 及 BRII-835 的 2 期 MRCT 联合用药研究启动患者筛选,并预计于 2021 年第二及第三季度在中国、香港、澳大利亚、台湾、新加坡、泰国和韩国进行 MRCT 研究。
此外,公司还在推进两种全人源非竞争性中和抗体(BRII-196 及 BRII-198)的鸡尾酒疗法,以供批准用于全球 COVID-19 患者的治疗。BRII-196 及 BRII-198 鸡尾酒疗法具有作为 SARS-CoV-2 抗体疗法的潜力,用于治疗 COVID-19,其具有更广的抗病毒谱(包括新出现的变种)以及长达六个月的保护。
从临床数据来看,Ⅰ期人用安全性及药代动力学 (PK) 研究表明,即使达到预期治疗剂量水平三倍,这些抗体依然具有安全性和耐受性。目前,公司针对门诊患者的 ACTIV-2 的 2 期╱3 期研究仍在进行中。
2
诺奖级别的技术,终将面临的考验
另外,作为一家未盈利生物科技公司,研发能力及技术路径是公司核心价值的关键之一。腾盛博药能够受到我们的关注,主要也是由于其使用的 siRNA 技术是一种高度创新的新型疗法,拥有广泛的应用前景,公司作为 siRNA 技术平台极具稀缺性。
siRNA 技术源于 1998 年 Andrew Fire 和 Craig Mello 在线虫中首次揭示的 RNAi 现象,这两位学者也正是凭借这一发现,于 2006 年获得了诺贝尔生理学奖。2018 年 Alnylam 公司的 Onpattro(Patisiran)由 FDA 批准上市,用于由 hATTR 引起的多发性神经病患者的治疗,成为首个获批上市的 siRNA 药物,终于将 siRNA 技术从基础科学发展到了成熟产品。
作为基因治疗中 RNA 药物最主流的类型,siRNA 药物是从 mRNA 的水平对疾病进行治疗,相比化学小分子药物及生物大分子药物,从技术路径上来看,siRNA 药物在蛋白质水平的治疗具有更高的效率。并且,经历 20 年的探索,siRNA 技术也已经熬过了发展初期的寒冬,成为了可及的新兴治疗方案。
但是,前沿技术在具有技术优势的前提下,也存在更大的风险。创新药公司百奥泰就在今年接连叫停 3 个在研项目,其中包含两项同样是前沿技术的 ADC 药物以及一项 PD-1 药物,分别是针对 HER2 的 ADC 药物 BAT8001、靶向 Trop2 的 ADC 药物 BAT8003 和 PD-1 的单克隆抗体 BAT1306,累计损失接近 3 亿元人名币的研发资金。腾盛博药的 siRNA 药物研发,是否也存在这种风险呢?
从 siRNA 药物的研发历史来看,2004 年美国 Opko 公司开发的 siRNA 药物 Bevasiranib,是全球首次与 siRNA 相关的临床实验,用于湿性老年黄斑变性治疗。随后,包括辉瑞、赛诺菲、罗氏及默沙东等在内的众多全球制药巨头,也纷纷加入到了 siRNA 药物的开发大军。
然而,siRNA 药物的研发之路并不是坦途,甚至可以说是命途多舛。Opko 公司的 Bevasiranib 项目因临床效果欠佳而折戟于 III 期临床中,其他后继者也相继失败。RNAi 药物内在的靶向性差、脱靶效应及稳定性问题成为了影响其疗效的最主要制约因素,加上其他诸多因素,最终导致这类药物治疗的效果远不及预期,同时还伴随着严重的无法克服的药物不良反应。
如此多家国际大厂都在 siRNA 药物的研发上损失惨重,其研发难度可见一斑。目前,腾盛博药最快的 siRNA 药物项目还处于临床Ⅱ期,由此可见,临床Ⅲ期将会是公司的一次大考。
3
小结
腾盛博药作为一家领先的专注公共卫生疾病的生物技术公司,其应用的 siRNA 技术拥有广阔的前景,并且属于目前最前沿的生物科技。公司在诸多未盈利生物科技中,具有很强的稀缺性和想象空间。
但是,公司也面临了未盈利生物科技公司难以避免的研发失败的风险。诸多国际医药大厂已经在 siRNA 药物的研发之上屡尝败绩,腾盛博药在面临挑战时的心境,不免也在这悲壮的气氛中显得更加沉重,在研产品的临床Ⅲ期结果将决定公司能否鱼越龙门。若能成功证明公司在 siRNA 药物上的研发能力,公司的未来才会是真正的星辰大海。

